Vedúci laboratória:
RNDr. Róbert Farkaš, CSc.
Zoznam členov laboratória:
Mgr. Milan Beňo, PhD.
Mgr. Denisa Beňová-Liszeková, PhD.
Magdaléna Bardačová
Doktorandi:
Mgr. Ľudmila Pečeňová
LABORATÓRIUM VÝVOJOVEJ GENETIKY (LVG)
1. - 2. Súčasné výskumné zameranie a získané výsledky
Hlavným zameraním laboratória vývojovej genetiky je štúdium ontogenetických procesov, najmä metamorfózy, využívajúc optimálny genetický model ovocnej mušky, metazoálny eukaryont, Drosophila melanogaster.
Výskumná činnosť laboratória je orientovaná predovšetkým na 4 okruhy problémov: (1.) hormonálne responzívne gény zapojené do iniciácie a regulácie bunkovej diferenciácie a morfogenézy, (2.) molekulárny mechanizmus účinku juvenilného hormónu (JH), (3.) gény zúcastnené v hormonálne-regulovanej programovanej bunkovej smrti a apokrinnej sekrécii, (4.) identifikácia a analýza funkcie génov bazálneho metabolizmu resp. posttranslacných modifikácií, ktoré zohrávajú tkanivovo alebo temporálne-špecifickú úlohu počas postembryonálnych vývojových fáz Drosophila melanogaster.
(1.) V rámci prvého okruhu problémov laboratórium vyhladáva a identifikuje tzv. skoré na steroidný hormón-responzívne gény a to ako na úrovni jedného modelového tkaniva, tak aj na úrovni celého organizmu. Cieľom prvej úrovne je pochopiť tkanivovo-špecifickú odozvu molekulárneho pôsobenia hormónov a jeho koordinovanej interakcie s inými signálnymi dráhami, kým zámerom druhého prístupu je vysvetliť integráciu hormonálnej odozvy organizmu ako celku počas postembryonálneho vývoja.
(2.) Na rozdiel od pomerne dobre preštudovaného mechanizmu účinku steroidného hormónu ekdyzonu, mechanizmus fungovania JH, produktu párovej žlazy corpora allata, nie je známy. Tento seskviterpenický hormón má rozhodujúci vplyv na smer vývinu t.j. rozhodnutie medzi alometrickým rastom alebo metamorfózou. Naše laboratórium vypracovalo detailnú 3D farmokofórnu analýzu nazatial 86 agonistov JH (Obr. 1) na základe podrobného vyhodnotenia morfogenetických úcinkov JH (Obr. 2) a generovali sme atomistický model väzobného miesta ligandu v putatívnom receptore JH.
(3.) Súčastou diferenciačných procesov jedných typov buniek a tkanív je regulovaná dizintegrácia iných tkanív aby sa zachovala rovnováha systému ako celku. Dizintegrácia alebo odstraňovanie nadpočetných, poškodených, chorých, prestárlych či inak obsolétnych buniek alebo celých tkanív sa deje procesom programovej bunkovej smrti (PCD), ktorý v mnohých prípadoch podlieha hormonálnej kontrole. Za využitia modelového tkaniva larválnych slinných žliaz sme identifikovali od dávky závislú úlohu tumor supresorového génu l(2)gl v implementácii PCD a celý rad pre PCD nových génov/proteínov, zväcša v endoplazmatickom retikule rezidentných chaperónov ako instantných faktorov priamo aktivujúcich jej exekučnú fázu.
Pôvodne neplánovanou časťou štúdia bunkovej smrti bol nález nekonvenčného typu extrúzie celulárnych komponentov slinnej žlazy Drosophila do centrálneho lúmenu krátko pred exekučnou fázou apoptózy. Transmisnou a neskôr aj rastrovacou elektrónovou mikroskopiou sme zistili, že sa jedná o apokrinnú sekréciu (Obr. 3), ktorej mechanizmus na rozdiel od exocytózy (merokrinnej sekrécie) nie je vôbec známy. Naša terajšia snaha je orientovaná smerom k identifikácii génov a nimi kódovaných proteínov regulujúcich proces apokrinnej sekrécie. (4.) Pôvodne integrálna súčasť problematiky prvého (1.) okruhu sa vzhľadom na získané výsledky stala samostatným projektom, v rámci ktorého sa v laboratóriu skúmajú 2 nezávislé skupiny enzýmov a ich génov. Do prvej skupiny patria metabolicky esenciálne malát dehydrogenázy, ktorých 4 gény z Drosophila melanogaster sme klonovali a charakterizovali z hľadiska ich ontogenetickej i biochemickej funkcie. Minimálne 2 z týchto enzýmov majú nenahraditelnú a limitujúcu úlohu pre reguláciu alometrického rastu v stereotypných fázach postembryonálneho vývoja Drosophila. Druhú skupinu enzýmov tvoria glykozyltransferázy zodpovedné za tkanivovo-špecifickú a unikátnu posttranslačnú modifikáciu sekrečných proteínov slinných žliaz Drosophila. Aby sa dosiahla maximálna súhra v produkcii, exocytóze a finálnej funkcii, expresia génov kódujúcich tieto sekrečné proteíny ako aj modifikujúce glykozyltransferázy je koordinovane regulovaná nárazovým pôsobením steroidného hormónu v priebehu velmi krátkeho obdobia. Tento tkanivový model nám slúži ako ideálny objekt pre štúdium a vysvetlenie molekulárnych mechanizmov zapojených do účinkovania steroidného hormónu na úrovni integrácie a koordinácie činnosti génov, ktorých produkty synergizujú do jedného bunkového procesu akým je v tomto konkrétnom prípade merokrinná sekrécia.
3. Zoznam projektov/grantov
Laboratóriu bolo doposial udelených vyše 15 grantov, a okrem VEGA a APVV grantov sme riešili granty NSF, NATO, EcoNet, 5. Rámcového programu EK a i. V súčasnosti sú aktívnymi grantami:
Nové analytické a diagnstické postupy na identifikáciu porúch apokrinných a holokirnných mechanizmov (EEA-NFM SK-0086/3655/2009/ORINFM) by EEF Norwegian Financial Mechanism, 2009-2011.
Molekulárne-genetická analýza hormonálne responzívnych a obligátnych malát dehydrogenáz u Drosophila melanogaster. melanogaster. VEGA (2/0170/10), 2010-2012.
Morfologické charakeristiky a moekulárne determinanty apokrinnej sekrécie. GACR P302/11/1640
4. Výber z používaných metód
Základom väcšiny experimentov je využívanie genetických nástrojov u Drosophila radom krížení na získavanie homozygótov, heteroalelických homozygótov, homozygótnych či homozygótne-heterozygótnych kombinácií s cieľom študovat fenotyp, analyzovať génové interakcie atď. Okrem celého radu biochemických metód, pravidelnou súčasťou našej práce je mutagenéza, PCR a RT-PCR, klonovanie a subklonovanie za účelom expresie v heterologických systémoch, purifikácie proteínov, analýzy proteín-proteínových interakcií, purifikácia a identifikácia interakčných partnerov tandémovou afinitnou chromatografiou a následnou hmotnostnou spektrometriou. Najčastejšie používanou metódou pre analýzu fenotypu je viacnásobná imunohistochémia v kombinácii s laserovou konfokálnou mikroskopiou, rekonštrukčná 3D mikroskopia, transmisná a rastrovacia elektrónová mikroskopia a iné.
5. Výber najvýznamnejších publikácií (IF ≥2) pracovníkov Laboratória vývojovej genetiky.
1. Akdemir F., Farkaš R., Chen P., Juhasz G., Medvedova L., Sass M., Wang L., Wang X., Chittaranjan S., Gorski S.M., Rodriguez A. and Abrams J.M. (2006) Autophagy occurs upstream or parallel to the apoptosome during histolytic cell death. Development 133 (8): 1457-1465. IF= 9,162
2. Liszeková D., Polakovičová M. Beno M. and Farkaš R. (2009) Molecular determinants of juvenile hormone action as revealed by 3D QSAR analysis in Drosophila. PLoS One. 4 (6): e6001. IF = 4,523
3. Wilson T.G., Wang S., Beňo M., Farkaš R. (2006) Wide mutational spectrum of a gene involved in hormone action and insecticide resistance in Drosophila melanogaster. Molec. Genet. Genomics 276 (3): 294-303. IF= 2,632
4. Beňo M, Liszeková D, Farkaš R. (2007) Processing of soft pupae and uneclosed pharate adults of Drosophila for scanning electron microscopy. Microsc. Res Tech. 70 (12): 1022-1027. IF=2,524
5. Sláma K., Farkaš R. (2005) Heartbeat patterns during the postembryonic development of Drosophila melanogaster. J. Insect Physiol. 51 (5): 489-503. IF = 2,310
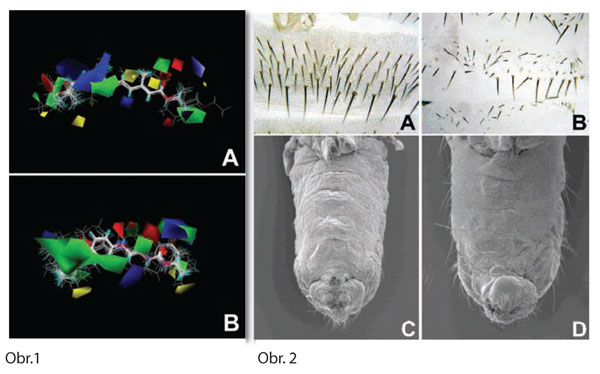
Obr. 1 Farmakofórna CoMFA analýza stérických a elektrostatických polí esenciálnych pre biologickú aktivitu a väzbu agonistov JH do svojho receptora špecifická pre alifatické (A) a oligocyklické (B) analógy.
Obr. 2 Morfogenetické účinky exogénne podaného JH (B, D) na postembryonálny vývin imaginálnych štruktúr externých senzorických orgánov (A, B) a na rotáciu genitálneho archu samcov (C, D).
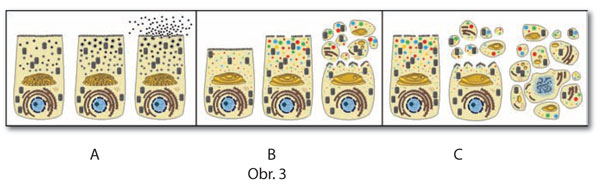
Obr. 3 Schéma troch typov sekrécie: (A) merokrinná sekrécia (exocytóza), (B) apokrinná sekrécia, (C) holokrinná sekrécia.